بقلم: يورونيوز
نشرت في
اعلان
كشف فريق بحثي دولي يضم علماء وطلابًا من جامعة تكساس في دالاس وكلية الطب في ويسكونسن عن ارتباط مباشر بين البكتيريا المعوية والألم المزمن الذي يعاني منه مرضى الخلايا المنجلية.
وقد نُشرت نتائج الدراسة في مجلة Cell Host & Microbe بعد إجراء تجارب على فئران وأنسجة بشرية، حيث ركّز الباحثون على بكتيريا محددة تُعرف باسم Akkermansia muciniphila، وهي بكتيريا طبيعية تعيش في الأمعاء البشرية لكنها تنخفض مستوياتها لدى مرضى الخلايا المنجلية.
ونجح الفريق في تخفيف الألم المزمن لدى فئران معدّلة وراثيًا لمحاكاة مرض الخلايا المنجلية، عبر زرع بكتيريا مستخرجة من براز فئران سليمة مباشرة في أمعاء الفئران المريضة. وكانت النتائج لافتة: اختفى الألم المزمن تقريبًا بعد الزرع.
وقالت الدكتورة كيتلين سادلر، الأستاذة المساعدة في علم الأعصاب بجامعة تكساس في دالاس والمؤلفة المراسلة للدراسة: “نتائجنا تشكل دليلاً قويًا على أن محتوى الميكروبيوم لدى الأفراد المصابين بمرض الخلايا المنجلية قد يكون سببًا في توليد الألم المزمن”.
نوعان مختلفان من الألم
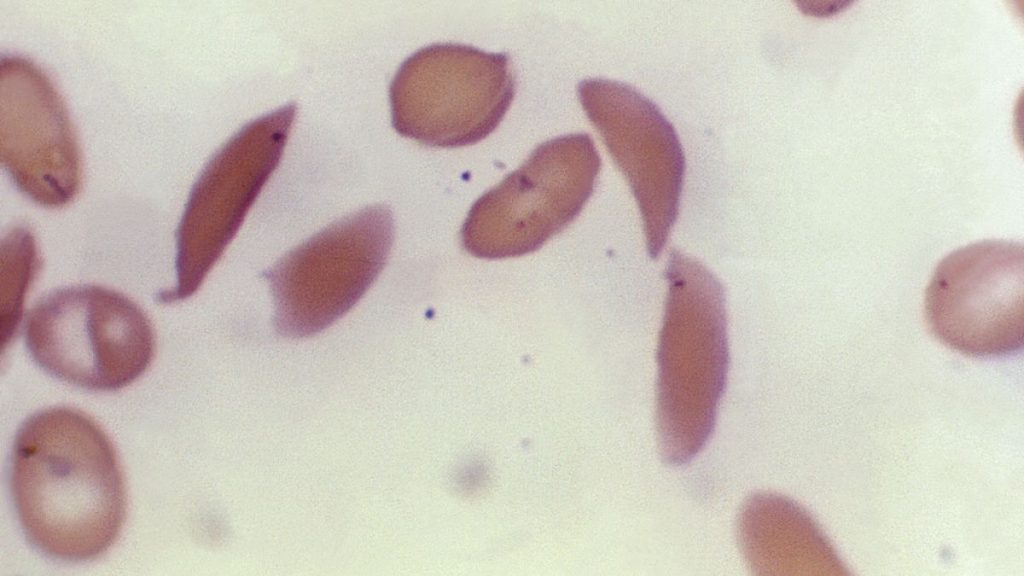
ومرض الخلايا المنجلية هو اضطراب وراثي يُسبب تشوه خلايا الدم الحمراء، فتصبح على شكل منجل وتُعيق تدفق الدم، مما يؤدي إلى نوبات ألم حادة. لكن الغموض لا يزال يلف سبب معاناة أكثر من نصف المرضى من ألم مزمن مستمر، حتى في غياب الأزمات الحادة.
وأضافت سادلر: “نوعا الألم، الحاد والمزمن، لهما آليات مرضية منفصلة. والميكروبيوم المعوي يُعتقد أنه يلعب دورًا في الألم المزمن.
البكتيريا والمركبات الأخرى في جهازك الهضمي لها تأثيرات متنوعة وواسعة النطاق تتجاوز ما قد يتوقعه الناس. جهازك المناعي يمكن أن يصبح أكثر نشاطًا استجابة لبكتيريا الأمعاء، وهذا له تداعيات واسعة في جسمك.
فكرة أن الميكروبيوم المعوي يُسبب الألم المزمن في أجزاء أخرى من الجسم أصبحت أكثر شيوعًا، حتى في أبحاث متلازمة الألم العضلي الليفي الحديثة”.
اكتشاف أول من نوعه
وأشارت سادلر إلى أن هذه الدراسة هي الأولى من نوعها التي تُحدد بكتيريا Akkermansia muciniphila كهدف محتمل لعلاج ألم الخلايا المنجلية، موضحة أن هذه البكتيريا تنتج أحماضًا دهنية قصيرة السلسلة تلعب دورًا حاسمًا في تخفيف الألم.
وتابعت: “عندما زرعنا هذه البكتيريا في فئران الخلايا المنجلية، تراجع الألم المزمن تقريبًا بالكامل. والأكثر إثارة للاهتمام أننا عندما نقلنا كل البكتيريا من فئران مريضة إلى فئران سليمة، انتقل معها الألم، ليس المرض الوراثي، بل فرط الحساسية للمس والبرودة”.
ميكروبيوم متغير وعلاج قابل للتطوير
ولفتت سادلر إلى أن التغيّر في تركيبة الأمعاء يمكن أن يُنشط نهايات عصبية في الجهاز الهضمي تُرسل إشارات إلى الدماغ والحبل الشوكي، مما يؤدي إلى ما يُعرف بـ”التحسس المركزي”، مضيفة: “كل شيء يصبح أكثر حساسية بسبب تغيّر في الدماغ أو الحبل الشوكي.”
ويُذكر أن ميكروبيوم الأمعاء يتغير باستمرار، يوميًا مع النظام الغذائي، وعلى المدى الطويل مع العمر ونمط الحياة والأدوية. وهذا ما يجعل العلاج بالبروبيوتيك خيارًا ديناميكيًا.
وأضافت: “البروبيوتيك مثل Akkermansia يمكن أن يكون مفيدًا جدًا في ظل هذا التطور المستمر، رغم أننا نعتقد أنه سيكون على الشخص في النهاية تغيير نوع البروبيوتيك، لأن البكتيريا في أمعائه قد تتكيف لقتل Akkermansia”.
طموح سريري
من جانبها، الدكتورة أماندا براندو، أستاذة طب الأطفال وأخصائية أمراض الدم في كلية الطب في ويسكونسن والمؤلفة الرئيسية للدراسة، والتي تعالج الأطفال المصابين بالمرض منذ سنوات، وصفت النتائج بأنها “مثيرة للغاية”.
وأضافت: “الألم المزمن لمرضى الخلايا المنجلية له تأثير سلبي عميق على جودة حياتهم. هذه النتائج تقدم بيانات ما قبل سريرية قوية لدعم إجراء تجارب سريرية باستخدام البروبيوتيك أو زرع الميكروبيوم البرازي كعلاج جديد للألم المزمن”.
واختتمت سادلر: “تطوير علاج دوائي للألم المزمن الناتج عن الخلايا المنجلية سيكون تغييرًا للحياة. هؤلاء المرضى لا يملكون اليوم سوى خيارات محدودة لإدارة الأعراض. الفئر